| Мышь_ДомОвая | Дата: Вс, 22.12.2019, 15:47 | Сообщение # 1 |

Группа: Администраторы
Сообщений: 127
Статус: Offline
| Аномалии уровней сывороточных аутоантител к антигенам нервной ткани у больных шизофренией: мультипараметрическая иммунологическая оценка (2015 год)
В статье содержаться таблицы, которые не влезают в стандартное окно. Чтобы видеть их полностью, внизу сообщения есть бегунок.
https://psyclinic-center.ru/nauka....tigenam
Орлова Вера Александровна – доктор медицинских наук, профессор, главный научный сотрудник Московского научно-исследовательского института психиатрии – филиала «ФМИЦПН им. В.П.Сербского» Минздрава России.Михайлова Ирина Иосифовна – кандидат медицинских наук, ведущий научный сотрудник Московского научно-исследовательского института психиатрии – филиала «ФМИЦПН им. В.П.Сербского» Минздрава России.Минутко Виталий Леонидович – доктор медицинских наук, профессор, руководитель клиники «Психическое здоровье».Симонова Альбина Валерьевна – доктор медицинских наук, профессор, директор по науке многопрофильного медицинского холдинга «Клиника современной медицины» («СМ-клиника»), эксперт по биотехнологиям Минобрнауки РФ.«Социальная и клиническая психиатрия», 2015, т. 25, № 4.- Московский научно-исследовательский институт психиатрии – филиал ФГБУ;
- «ФМИЦПН им. В.П.Сербского» Минздрава России;
- Клиника «Психическое здоровье», Москва;
- Клиника современной медицины (СМ клиника), Москва.
Методы современной иммунохимии позволяют существенно уточнить состояние структур нервной ткани и происхождение их аномалий, что обусловливает необходимость их использования в исследованиях шизофрении.С целью выявления специфических иммунных изменений, отражающих состояние микроструктур нервной ткани при шизофрении, было обследовано 70 больных параноидной шизофренией (F20.01–F20.03 по МКБ-10) в состоянии обострения и 100 психически здоровых лиц контрольной группы. Для определения уровней сывороточного содержания нейротропных аутоантител (ауто-АТ) класса IgG использовался метод «ЭЛИ-Н-Тест» (МИЦ «Иммункулюс», Москва), на основе твердофазного ИФА.У большинства больных (91,4%), в отличие от лиц контрольной группы (3%), отмечались отклонения уровня нейротропных ауто-АТ как в сторону повышения, так и снижения. Тенденция к повышению уровня АТ значительно преобладала над снижением (77% повышенных и 23% сниженных показателей на общее число измененных показателей в выборке). Наиболее часто выявлялось повышение содержания ауто-АТ к глиальному фибриллярному кислому белку (GFAP), основному белку миелина (MBP) и специфическому белку аксонов NF-200 (у 37,2%, 37,1% и 34,3% лиц соответственно), что может отражать нейродегенерацию, сопровождающуюся демиелинизацией и патологическими процессами в астроцитарной глие. Отклонения в уровнях ауто-АТ к GABA и н-ацетилхолиновым рецепторам (у 27% и 24,3% больных соответственно) указывали на изменения в соответствующих нейронных системах. Аномалии уровней ауто-АТ к вольтажзависимому кальциевому каналу (VGCC) (25,7%) предполагали нарушения водно-электролитного баланса и энергетического метаболизма нейронов, нарушения функции нервно-мышечных контактов и нейрон-нейронных взаимодействий. Отклонения параметров ауто-АТ к двуспиральной ДНК (22,9% случаев) и β-2-гликопротеину (22,9% случаев) демонстрировали сопряженность выявленных нарушений в нервной системе с неспецифической иммунной активацией, связанной с системными воспалительными процессами. Достоверные корреляции изученных иммунохимических характеристик варьировали от слабых до умеренных (r от 0,24 до 0,49, p<0,05).Обсуждается вероятность детерминации установленных нарушений хронической инфекцией.
В настоящее время происходит становление новых взглядов на биологическое предназначение иммунной системы, на ее участие в регуляции физиологических функций, на естественный (физиологический) аутоиммунитет [7, 49, 56, 61]. Согласно представлениям, в частности, А.Tauber, любые физиологические аутоиммунные реакции отличаются от патологических лишь степенью выраженности [56]. В этой связи, представляется целесообразным постепенно переходить от излишне упрощенной (обнаружены такие-то аутоантитела – следовательно, выявлена патологическая составляющая процесса), механистической трактовки некоторых аутоиммунных феноменов к более диалектичной (аутоантитела есть всегда и у всех здоровых и больных, а вторичные изменения в их составах отражают динамические изменения в органах и системах тела).Новые взгляды на роль иммунной системы базируются на представлениях о ее непосредственном участии в поддержании постоянства молекулярного состава организма и гомеостатической регуляции самых разных молекулярно-клеточных процессов в изменяющихся условиях внешней и внутренней среды. Рассматриваемые сложные функции иммунной системы основываются на всепроникающей мультикомпонентной системе естественных аутоантител, живо откликающейся количественными изменениями на самые разные функционально-метаболические перестройки в обособленных популяциях клеток, органах и организме в целом. Как было многократно подтверждено разными исследователями во многих лабораториях, множество естественных ауто-АТ, специфичных для самых разных ауто-АГ, постоянно синтезируются, секретируются и присутствуют в сыворотке крови и иных биологических средах каждого здорового человека. Совокупность ауто-АТ, направленных к различным мембранным, цитоплазматическим и ядерным антигенам клеток организма и межклеточного матрикса, а также секреторным продуктам клеток, как в зеркале отражает антигенную структуру организма и формирует динамический «Иммунологический гомункулус», или «Иммункулус» (по аналогии с неврологическим «Гомункулусом», отражающим особенности анатомии организма). «Иммункулус» организован по голографическому принципу, где каждая часть целого отражает это целое. Поэтому содержание ауто-АТ одной и той же антигенной специфичности у индивида мало отличается при взятии проб крови из различных сосудов.Уровни отмирания (апоптоз) и замещения (репарация) клеток любого органа у здоровых людей колеблются в пределах очень узкого коридора значений, то есть приблизительно одни и те же. Это позволяет по изменениям в содержании ауто-АТ определенной органоспецифичности получать информацию о состоянии популяций специализированных клеток разной анатомической локализации, повреждениях разных органов тела, изменениях экспрессии/ продукции/секреции определенных рецепторов, биорегуляторов, дифференцировочных АГ и т. д. Лабораторные исследования, в ходе которых у пациентов определяется сывороточное содержание десятков отдельных ауто-АТ (например, ауто-АТ к ДНК, кардиолипину, бета-2-гликопротеину, коллагену, инсулину, глутаматдекарбоксилазе), проводятся во всем мире. В некоторых работах они изучались и у больных шизофренией. Так, у больных шизофренией было показано повышенное содержание сывороточных антител к фактору роста нервов (зависящее от степени прогредиентности заболевания), С-реактивному протеину. В связи с выявлением повышенного содержания антител к глютаматным рецепторам при шизофрении была выдвинута гипотеза «глутаматного энцефалита» при этом заболевании.Однако, диагностическое и/или прогностическое значение заключения, основанного на одновременном определении содержания ауто-АТ разной специфичности, значительно повышается. Поэтому дальнейшие исследования должны быть направлены на мультикомпонентную оценку содержания ауто-АТ, что позволило бы провести системный анализ и уточнить роль и участие патоиммунных механизмов в развитии шизофрении. Проведение такого рода исследований стало возможным в связи с появлением новых технологий, позволяющих более дифференцированно выявлять иммунометаболические аномалии, свойственные различным, в том числе психическим болезням. К таким технологиям относится комплексная оценка аутоиммунитета (иммуноферментный анализ «ЭЛИ-Тест», разработчик МИЦ «Иммункулус». Технология позволяет анализировать изменения профилей сывороточной иммунореактивности, зависящей от избирательных изменений в содержании тех или иных аутоантител.Целью данного исследования явилась мультипараметрическая оценка иммунохимических аномалий (отклонений содержания ауто-антител), отражающих состояние микроструктур нервной системы при шизофрении.Материал и методыБыло обследовано 70 больных (33 муж., 37 жен.) шизофренией, проходивших стационарное лечение по поводу острых психотических состояний. Клиническая диагностика заболевания проводилась с использованием МКБ-10. У всех пациентов была диагностирована параноидная шизофрения с сохранением редуцированной аффективной и субпсихотической симптоматики разной степени выраженности в ремиссиях (F20.01–F20.03). Контрольную группу составили 100 психически здоровых лиц (мужчин и женщин), проходивших профилактическое обследование в МИЦ «Иммункулус». Средний возраст больных составил 33,8±11,8 лет, средний возраст контрольных – 32,9±9лет.Иммунохимическое обследование проводилось при поступлении больных в стационар до начала терапии. Профили иммунореактивности естественных регуляторных аутоантител, наиболее информативно отражающие количественные изменения (содержание/аффинность) их отдельных вариантов [46, 50] оценивали в сыворотке крови с помощью тест-наборов «ЭЛИ-П-Комплекс» («Иммункулус», Москва, Россия), согласно инструкции производителя. При этом c помощью твердофазного ИФА определяли изменения содержания аутоантител класса IgG, взаимодействующих с антигенами микроструктур нервной ткани, а также отражающих общую реактивность иммунной системы (табл. 1).В зависимости от амплитуды пиков индивидуальных аутоантител разной антигенной специфичности, их иммунореактивность оценивали как нормальную – при амплитуде пика, не выходящей за физиологически допустимый разброс (от -20% до +10% от среднего индивидуального уровня иммунореактивности), сниженную (ниже -20%) или повышенную (свыше +10%). Следует отметить, что с помощью технологии ЭЛИ-Тест не проводится оценка абсолютного содержания (концентраций) ауто-АТ в сыворотке крови обследуемого: результаты ЭЛИ-Тестов характеризуют нарушения нормальных соотношений ауто-АТ (искажения «профилей иммунореактивности»).Подчеркнем, что «профили иммунореактивности» ауто-АТ являются наиболее информативными параметрами [46, 50] и значимость этих показателей для выявления патологических изменений в организме оказывается существенно выше, нежели оценка абсолютных концентраций отдельных ауто-АТ. При этом на выявление изменений «профилей иммунореактивности» не влияет уровень активности иммунной системы обследуемого (иммунодефицит, иммуноактивация или нормо-реактивность). Чем большее число маркерных ауто-АТ одновременно анализируется для выявления аномалий, тем более точной и значимой получается картина изменений их профилей.Для изучения взаимосвязей между исследуемыми параметрами проводился корреляционный анализ в программе Statistica 6.0.РезультатыАномалии профилей сывороточной иммунореактивности, обусловленные исследованными ауто-АТ, были обнаружены у большинства пациентов (91,4%) и только у 3% обследованных контрольной группы. Превалирующим был рост амплитуды пиков (77%), реже встречалось их аномальное снижение (23%), что существенно отличалось от соответствующих показателей контрольной группы (2,5% и 0,7% соответственно). Как было показано при различных формах патологии, повышенные значения отражают активные патологические процессы относительно небольшой давности, аномальное же снижение пиков иммунореактивности характерно для патологических процессов большей давности и тяжести.Аномалии содержания ауто-АТ к глиальному фибриллярному кислому белку (GFAP), основному белку миелина (MBP) и специфическому белку аксонов NF-200 выявлялись наиболее часто (в 37,2%, 37,1% и 34,3% случаев соответственно по сравнению с 3%, 0% и 3% соответственно у лиц контрольной группы). Аномалии чаще всего выражались повышением уровня ауто-АТ к рассматриваемым антигенам (в 32,9%, 30% и 28,6% случаев соответственно). Повышение уровней ауто-АТ к GFAP может сопровождать пролиферативные процессы в астроцитарной глие (глиоз) [21]. Глиоз может быть представлен широким спектром изменений – от активации астроцитов, характеризующейся обратимыми изменениями в экспрессии генов и гипертрофией клеток с сохранением интактной структуры ткани до необратимого формирования глиального рубца и изменением тканевых структур [9]. Как известно, процесс активации астроцитарной глии запускается в тканях головного мозга в ответ на повреждение нейронов различного генеза (ишемического, инфекционного-воспалительного, травматического, дегенеративного). По мнению некоторых авторов [25], повышенное содержание ауто-АТ к GFAP может говорить о нейрональных потерях.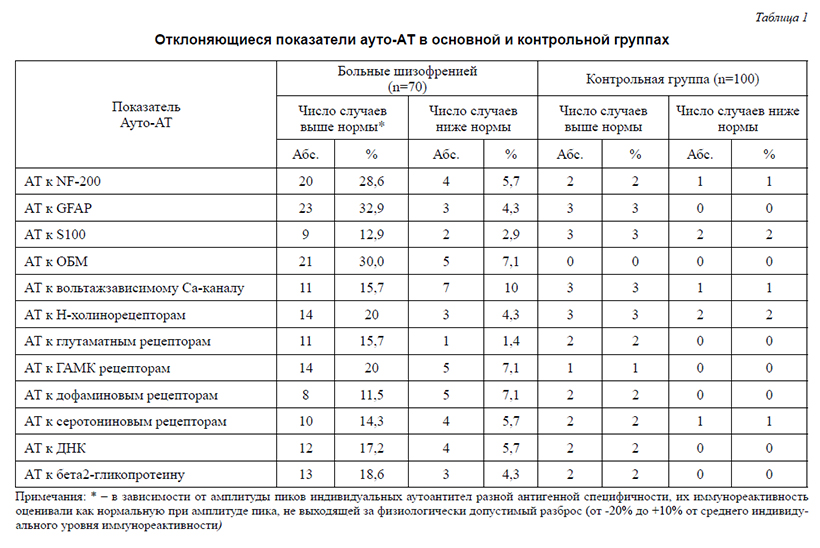 Можно также предположить, что длительное повышение содержания ауто-АТ к GFAP будет сопряжено с дистрофическими процессами в астроцитах. Кроме того, это повышение может свидетельствовать и о нарушении барьерной функции ГЭБ [25]. Отклонения содержания ауто-АТ к MBP и NF-200 в сторону повышения с высокой долей вероятности могут указывать на дегенеративные изменения в аксонах, включая их миелиновые оболочки (демиелинизация) [3, 21].Аномалии содержания ауто-АТ к ГАМК-рецепторам, н-холинорецепторам (у 27,1% и 24,3% больных и 1% и 5% лиц контрольной группы соответственно), к глутаматным, дофаминовым, серотониновым рецепторам (17,1%, 18,6% и 20% больных и 2%, 2% и 3% лиц контрольной группы, соответственно) выявлялись несколько реже. Отмеченные аномалии могут указывать на изменения в соответствующих системах нейронов.Аномалии в содержании ауто-АТ к вольтажзависимому кальциевому каналу (VGCC) были обнаружены в 25,7% случаях по сравнению с 4% случаев в контрольной группе. Как известно,VGCC идентифицированы в мембране не только нейронов, но и эндокринных и мышечных клеток. В последние годы показана их исключительно многообразная и важная роль в целом ряде клеточных и системных функций организма [11, 43 и др.], в том числе в поддержании некоторых динамических процессов в нейронах, критически влияющих на нервную возбудимость, а также в инициации секреции эндокринных клеток. Аномалии содержания ауто-АТ к антигенам VGCC могут предполагать широкий спектр расстройств с нарушениями водно-электролитного баланса и энергетического метаболизма нейронов, изменения соотношений между возбуждающими и тормозными процессами в нервной системе, нарушения функций межнейронных и нервно-мышечных контактов [1, 2], эндокринный дисбаланс [28]. Они могут свидетельствовать и о вовлечении в патологические процессы спинного мозга и мозжечка [30, 37].У 12,9% пациентов (и лишь у 3% лиц в контрольной группе) отмечалось повышение содержания ауто-АТ к белкам группы S100 – кальций-зависимым регуляторам целого ряда клеточных функций, обеспечивающих функциональный гомеостаз клеток мозга путем сопряжения и интеграции разноплановых метаболических процессов [6, 24]. S-100В является маркером активации астроцитарной глии [9]. Повышение содержания ауто-АТ к такому представителю белков группы S100, как S-100В, по-видимому, отражает деструктивные изменения нервной ткани и ее вовлеченность в воспалительную реакцию, часто связанную с вирусной инфекцией (за счет сходства эпитопов белков S100 с эпитопами некоторых вирусов – в частности, вируса папилломы человека). Кроме того, поскольку S100-белки во внеклеточном секторе проявляют свойства цитокинов и взаимодействуют с RAGE-рецепторами [32], которые экспрессируются в нервной системе не только нейронами, микроглией и астроцитами, но и клетками сосудистой стенки, можно предположить вовлеченность в воспалительную реакцию и сосудистой сети. Выявление повышенных уровней ауто-АТ к S-100В может подтверждать патологические процессы в астроцитарной глие [54], что уже было предположено у значительной части обследованных больных по повышению уровня ауто-АТ к GFAP .Отклонения параметров ауто-АТ к двуспиральной ДНК (17,2% случаев в группе пациентов в сравнении с 2% в контрольной группе) и β-2-гликопротеину (18,6% случаев у больных против 2% в контрольной группе) в сторону повышения демонстрировали взаимосвязь описанных изменений в нервной системе с неспецифической иммунной активацией (системным воспалением, включая воспаление в сосудистой сети). Чаще всего такие отклонения в содержании ауто-АТ бывают обусловлены активно реплицирующимися внутриклеточными инфектами (обычно вирусными) [21].Повышение ауто-АТ к β-2-гликопротеину может отражать интенсификацию их взаимодействий с белково-фосфолипидными комплексами клеточных мембран, а также процессы, связанные с возможным повреждением эндотелия сосудистых стенок («васкулопатия») и повышением свертываемости крови (антифосфолипидный синдром) [21]. Указанные процессы у пациентов с повышенным содержанием ауто-АТ к β-2-гликопротеину, таким образом, могут иметь распространенный характер. Отметим, что повышение уровня ауто-АТ к β-2-гликопротеину может быть индуцированно инфекционным процессом [21]. По нашим предварительным данным, изменения данных маркеров сопряжены с наличием хронических латентных бактериально-вирусных процессов, связанных с заболеваниями носоглотки, а также функциональных нарушений органов ЖКТ, пищевой аллергии, выраженным синдромом избыточного бактериального роста в кишечнике, дисбиозом бактериального роста.Достоверные корреляции изученных иммунохимических характеристик варьировали от слабых до умеренных (r от 0,24 до 0,49, p< 0,05) (табл. 2). Важным является то обстоятельство, что они включили не только взаимосвязи между изменениями уровней отдельных ауто-АТ, отражающих локальные изменения в нервной ткани, но также и взаимосвязи отмеченных изменений с отклонениями в содержании ауто-АТ, отражающие системные изменения (отклонения содержания ауто-Ат к β-2-гликопротеину). В частности, степень предположенных патологических процессов в астроглие у обследованных больных шизофренией оказалась сопряженной с воспалительными проявлениями. Можно также предположить, что длительное повышение содержания ауто-АТ к GFAP будет сопряжено с дистрофическими процессами в астроцитах. Кроме того, это повышение может свидетельствовать и о нарушении барьерной функции ГЭБ [25]. Отклонения содержания ауто-АТ к MBP и NF-200 в сторону повышения с высокой долей вероятности могут указывать на дегенеративные изменения в аксонах, включая их миелиновые оболочки (демиелинизация) [3, 21].Аномалии содержания ауто-АТ к ГАМК-рецепторам, н-холинорецепторам (у 27,1% и 24,3% больных и 1% и 5% лиц контрольной группы соответственно), к глутаматным, дофаминовым, серотониновым рецепторам (17,1%, 18,6% и 20% больных и 2%, 2% и 3% лиц контрольной группы, соответственно) выявлялись несколько реже. Отмеченные аномалии могут указывать на изменения в соответствующих системах нейронов.Аномалии в содержании ауто-АТ к вольтажзависимому кальциевому каналу (VGCC) были обнаружены в 25,7% случаях по сравнению с 4% случаев в контрольной группе. Как известно,VGCC идентифицированы в мембране не только нейронов, но и эндокринных и мышечных клеток. В последние годы показана их исключительно многообразная и важная роль в целом ряде клеточных и системных функций организма [11, 43 и др.], в том числе в поддержании некоторых динамических процессов в нейронах, критически влияющих на нервную возбудимость, а также в инициации секреции эндокринных клеток. Аномалии содержания ауто-АТ к антигенам VGCC могут предполагать широкий спектр расстройств с нарушениями водно-электролитного баланса и энергетического метаболизма нейронов, изменения соотношений между возбуждающими и тормозными процессами в нервной системе, нарушения функций межнейронных и нервно-мышечных контактов [1, 2], эндокринный дисбаланс [28]. Они могут свидетельствовать и о вовлечении в патологические процессы спинного мозга и мозжечка [30, 37].У 12,9% пациентов (и лишь у 3% лиц в контрольной группе) отмечалось повышение содержания ауто-АТ к белкам группы S100 – кальций-зависимым регуляторам целого ряда клеточных функций, обеспечивающих функциональный гомеостаз клеток мозга путем сопряжения и интеграции разноплановых метаболических процессов [6, 24]. S-100В является маркером активации астроцитарной глии [9]. Повышение содержания ауто-АТ к такому представителю белков группы S100, как S-100В, по-видимому, отражает деструктивные изменения нервной ткани и ее вовлеченность в воспалительную реакцию, часто связанную с вирусной инфекцией (за счет сходства эпитопов белков S100 с эпитопами некоторых вирусов – в частности, вируса папилломы человека). Кроме того, поскольку S100-белки во внеклеточном секторе проявляют свойства цитокинов и взаимодействуют с RAGE-рецепторами [32], которые экспрессируются в нервной системе не только нейронами, микроглией и астроцитами, но и клетками сосудистой стенки, можно предположить вовлеченность в воспалительную реакцию и сосудистой сети. Выявление повышенных уровней ауто-АТ к S-100В может подтверждать патологические процессы в астроцитарной глие [54], что уже было предположено у значительной части обследованных больных по повышению уровня ауто-АТ к GFAP .Отклонения параметров ауто-АТ к двуспиральной ДНК (17,2% случаев в группе пациентов в сравнении с 2% в контрольной группе) и β-2-гликопротеину (18,6% случаев у больных против 2% в контрольной группе) в сторону повышения демонстрировали взаимосвязь описанных изменений в нервной системе с неспецифической иммунной активацией (системным воспалением, включая воспаление в сосудистой сети). Чаще всего такие отклонения в содержании ауто-АТ бывают обусловлены активно реплицирующимися внутриклеточными инфектами (обычно вирусными) [21].Повышение ауто-АТ к β-2-гликопротеину может отражать интенсификацию их взаимодействий с белково-фосфолипидными комплексами клеточных мембран, а также процессы, связанные с возможным повреждением эндотелия сосудистых стенок («васкулопатия») и повышением свертываемости крови (антифосфолипидный синдром) [21]. Указанные процессы у пациентов с повышенным содержанием ауто-АТ к β-2-гликопротеину, таким образом, могут иметь распространенный характер. Отметим, что повышение уровня ауто-АТ к β-2-гликопротеину может быть индуцированно инфекционным процессом [21]. По нашим предварительным данным, изменения данных маркеров сопряжены с наличием хронических латентных бактериально-вирусных процессов, связанных с заболеваниями носоглотки, а также функциональных нарушений органов ЖКТ, пищевой аллергии, выраженным синдромом избыточного бактериального роста в кишечнике, дисбиозом бактериального роста.Достоверные корреляции изученных иммунохимических характеристик варьировали от слабых до умеренных (r от 0,24 до 0,49, p< 0,05) (табл. 2). Важным является то обстоятельство, что они включили не только взаимосвязи между изменениями уровней отдельных ауто-АТ, отражающих локальные изменения в нервной ткани, но также и взаимосвязи отмеченных изменений с отклонениями в содержании ауто-АТ, отражающие системные изменения (отклонения содержания ауто-Ат к β-2-гликопротеину). В частности, степень предположенных патологических процессов в астроглие у обследованных больных шизофренией оказалась сопряженной с воспалительными проявлениями.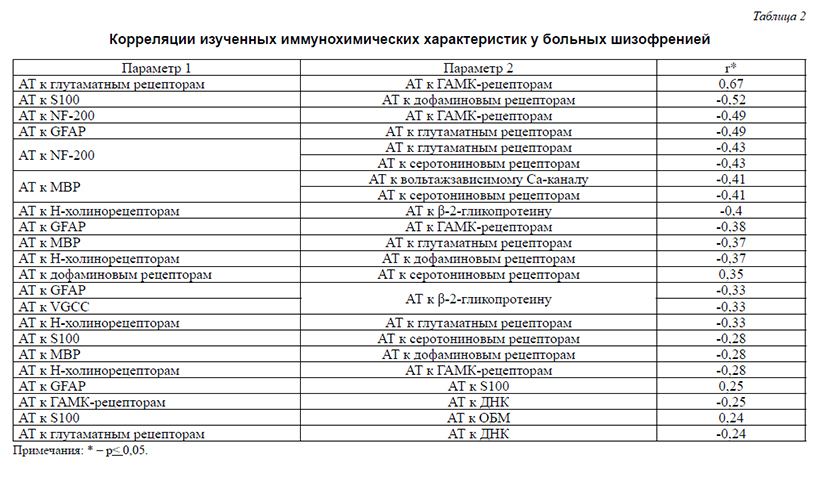 ОбсуждениеПроведенное исследование выявило у обследованных больных шизофренией существенные аномалии профилей ауто-АТ – молекул, обеспечивающих гомеостатическую регуляцию самых разных молекулярно-клеточных процессов, в том числе касающихся функционального сопряжения нервной и иммунной систем. У значительного числа пациентов было выявлено повышение уровней ауто-АТ, которое может отражать деструктивные и воспалительные процессы в тканях головного, спинного мозга и периферической нервной системы (GFAP, MBP, NF-200, S-100В, VGCC), а также нарушение проницаемости ГЭБ. В настоящей работе в значительной части случаев было также отмечено повышение содержания ауто-АТ к двуспиральной ДНК и β-2-гликопротеину, которое может указывать на распространенные воспалительные изменения и усиление апоптоза, развитие сосудистых расстройств. Корреляционные связи изученных иммунохимических признаков предполагают сопряженность патологических процессов в астроглие у больных шизофренией с воспалительными проявлениями. Эти данные подтверждают результаты других работ, выявляющих при этом заболевании биохимические маркеры воспалительных реакций и повреждения эндотелия сосудов [31]. Как показывают выявленные в проведенном исследовании изменения в содержании ауто-АТ к MBP, NF-200, VGCC, психиатрическая симптоматика (в частности, связанная с расстройствами мышечного тонуса) может иметь как центральный, так и периферический генез. Полученные данные свидетельствуют о необходимости изучения шизофрении как системного заболевания с использованием не только психиатрического, но и других интегративных медицинских подходов.Результаты проведенного исследования находятся в соответствии с целым рядом данных, полученных при изучении патогенеза шизофрении с привлечением методов других научных дисциплин. В частности, установленные данные, предполагающие дегенеративные процессы в нервной системе, подтверждают результаты некоторых катамнестических МРТ-исследований [45], выявляющих прогрессирующую редукцию структур мозга у больных шизофренией, а также наши данные, установившие с использованием сложных морфометрических индексов прямые МРТ-признаки нейродегенерации при шизофрении, преобладающие над признаками врожденной гидроцефалии [12].Иммунохимические признаки, предполагающие процессы демиелинизации у исследованных больных шизофренией (повышение уровня ауто-АТ к МBP), подтверждают данные посмертных патоморфологических исследований [29], обосновывающих поражение миелиновых оболочек нервов как характерное для шизофрении. Полученные данные в совокупности с результатами отмеченных исследований могут служить структурно-функциональным обоснованием результатов нейропсихологических работ, свидетельствующих о нарушениях корково-корковых и корково-подкорковых взаимодействий при шизофрении [20].Следует отметить, что традиционно подчеркивалась ареактивность глии при шизофрении, что в свое время явилось отправной точкой для квалификации структурных аномалий мозга при шизофрении в качестве аномалий развития. Однако в отдельных патоморфологических исследованиях [35] глиоз все же выявлялся в перивентрикулярном пространстве, височно-лимбических структурах, стволе мозга больных. В большинстве современных исследований подтверждено отсутствие классических признаков астроглиоза при шизофрении [см. обзор 9].В то же время имеются данные об изменениях ультраструктуры астроцитов и экспрессии их маркеров при шизофрении, что свидетельствует об активном вовлечении этих клеток в патологический процесс и их активации [9]. Более того, патоморфологические данные свидетельствуют о том, что дисфункция астроцитов при шизофрении прогрессирует по мере увеличения длительности заболевания [39]. Высказано предположение, что патологические процессы в астроцитах у больных шизофренией связаны с иммунными изменениями, что подтверждается результатами настоящего исследования на основании повышения уровня ауто-АТ к GFAP и S-100 (В).Установленные у обследованных больных шизофренией отклонения в уровне ауто-АТ к белку S-100 (В) согласуется с исследованиями, выявляющими изменения содержания этого белка в сыворотке крови больных [см. обзор 58]. S100 – это группа иммунологически тождественных кислых кальций-связывающих белков, различающихся по молекулярной массе и заряду. Концентрация белков S100 в мозге в 100000 раз превышает содержание в других тканях и составляет до 90% растворимой фракции белков нервных клеток [6]. В мозге S100 синтезируются глиальными клетками, 90% этих белков соcредоточено в астроцитах. В клетке белки S100 локализуются в цитоплазме, и, в меньшей степени, – в синаптической мембране и хроматине. В зависимости от концентрации S-100 оказывают трофическое или токсическое действие на нейроны и глиальные клетки. Они выступают как медиаторы во взаимодействии глии и нейронов и в целом, в качестве одного из узловых молекулярных компонентов сложных внутриклеточных систем, обеспечивающих функциональный гомеостаз клеток мозга[24].Экспериментальные воздействия на белки S1OO обычно не сопровождаются заметным ухудшением соматического состояния животных, но одновременно приводят к резким и разнообразным нарушениям интегративной функции мозга и информационного гомеостаза [24]. Подобные изменения характерны и для больных шизофренией. В этом контексте важно, что отклонения в сывороточном содержании белков S-100 (S-100В) (чаще в сторону повышения), выявленные в целом ряде исследований при шизофрении[58], трактуются как подтверждающие его вовлеченность в патогенез заболевания и участие в нейродегенеративных и/или регенеративных механизмах.Иммунохимические признаки, которые косвенно могут указывать на нарушения водно-электролитного баланса и энергетического метаболизма нейронов (повышение уровня ауто-АТ к VGCC), подтверждаются данными посмертных иммунохимических исследований мозга больных шизофренией [2], определяющих отмеченные нарушения, в частности, связанные с метаболизмом глутамата. Нарушения водно-электролитного баланса могут приводить к отечности мозга, что прежде отмечалось нами при проведении МРТ-исследований [13, 16]. Поскольку повышение иммунорективности ауто-АТ к VGCC является характерным для заболеваний с вовлечением в патологические процессы мозжечка (мозжечковая атаксия) и спинного мозга (боковой амиотрофический склероз) [30, 37], полученные данные позволяют предположить участие упомянутых структур в патологических процессах при шизофрении. Последние могут протекать в более легкой форме, о чем свидетельствует отсутствие у больных шизофренией симптоматики, свойственной отмеченным заболеваниям. Высказанное предположение подкрепляется результатами прижизненных и посмертных морформетрических исследований, обнаруживших структурные аномалии мозжечка при шизофрении [10, 36], а также результатами нейропсихологических исследований, выявляющих дисфункции мозжечка у пациентов и их вклад в нарушение когнитивных функций в целом [5]. Аномалии спинного мозга при шизофрении также отмечались в литературе [19].Следует отметить, что значительная часть представленных в данной работе пациентов была обследована с использованием нейропсихологического метода и метода МР-ангиографии, выявивших у них патологию белых проводящих путей между долями полушарий, между полушариями большого мозга и мозжечком [4, 5], а также нарушение церебрального кровообращения [13]. Последнее характеризовалось функциональной патологией в системе мозговых коллекторов, крупных сосудов и капиллярной сети, взаимосвязанной с анатомической патологией (расширение периваскулярных пространств, периваскулярные кисты, очаги дистрофии в белом веществе мозга). В последние годы также и на посмертном материале [60] были установлены неспецифические изменения ультраструктуры капилляров в префронтальной и зрительной коре при шизофрении, рассматривающиеся как характерные для заболевания.Эти данные подтверждают выдвинутые на основании иммунохимического обследования (повышение иммунореактивности к антигенам MBP и NF-200, β-2-гликопротеину) предположения о патологии аксонов у обследованных пациентов, а также повреждении эндотелия сосудов.Как известно, аномально избыточная продукция ауто-АТ, будучи в большинстве случаев вторичным явлением, отражает первичные аномалии со стороны соответствующих антигенов (например, при развитии локальных воспалительных процессов, аномалиях экспрессии и секреции соответствующих продуктов). При этом повышенная продукция ауто-АТ направлена на активацию клиренса и утилизацию избытка таких продуктов и является саногенной [23]. Существенно реже наблюдается первичное, то есть не обусловленное нуждами организма, патогенное повышение продукции определенных ауто-АТ, которые выступают инструментами иммунометаболических нарушений разной степени выраженности, вплоть до аутодеструктивных реакций [23].Таким образом, аномалии профилей сывороточной иммунореактивности, обусловленной теми или иными аутоантителами, могут (чаще всего) отражать избыточное поступление соответствующих антигенов в межклеточные пространства, например, при патологической активации их продукции и/или избыточной гибели клеток, их продуцирующих. Имеются данные о том, что повышенный уровень ауто-АТ к антигенам тех или иных органов и систем может быть связан с наличием вирусного (внутриклеточного) инфекционного процесса. Так, избыток ауто-АТ к двуспиральной ДНК чаще всего бывает обусловлен активацией процессов апоптоза, вызванной активно реплицирующимися внутриклеточными инфектами (обычно вирусными) [21]. Патологический подъем продукции ауто-АТ к белкам S100 могут вызывать многие варианты вирусов папилломы (по механизмам молекулярной мимикрии). По данным иммунологических исследований [21, 26], аутоиммунным процессам, сопровождающимся выраженной органной деструкцией, предшествуют десятилетиями протекающие инфекционно-воспалительные повреждения, часто вызываемые вирусами герпеса. В связи с этим возможно предположить, что повышенный уровень ауто-АТ к нервной ткани может быть связан с наличием латентной вирусной инфекции (латентный энцефалит), что выдвигалось как гипотеза еще с 20-х годов прошлого столетия и имеет ряд подтверждений на современном этапе развития научных исследований [34]. В части же случаев речь может идти о латентном генерализованном инфекционном процессе. Это предположение подкрепляется накопленными в последние десятилетия данными, свидетельствующими о вовлеченности вирусов (в частности, герпеса) в патогенез шизофрении [52, 59 и др.], что проявляется не только сопряженностью уровня сывороточных противовирусных антител с психопатологической симптоматикой [14, 15, 47], но и с дегенерацией мозговых структур [13, 53]. Дополнительный вклад в эти процессы может вносить и другая патогенная микрофлора [19, 47], в частности, такой внутриклеточный паразит, как токсоплазма [57].Как уже отмечалось, реже аномалии профилей сывороточной иммунореактивности отражают первичную аутоиммунную патологию, в которой ауто-АТ играют роль прямых факторов патогенеза. Являются ли выявленные нами (характерные для больных шизофренией) системные аномалии профилей иммунореактивности указанием на первичные аномалии экспрессии, к примеру, дофаминовых и серотониновых рецепторов и патологическую пролиферацию и апоптоз глиальных клеток? Или же выявленные иммунохимические изменения играют роль прямых факторов патогенеза? Хотя, как рассмотрено выше, больше данных за первое предположение, в рамках проведенного анализа без дополнительных углубленных исследований однозначно ответить на эти вопросы не представляется возможным. Однако уже на данном этапе накопления знаний, свидетельствующих о возможном выявлении у больных шизофренией признаков распространенного воспалительного процесса, коррелирующего с повреждением нервной ткани, встает необходимость проведения тщательного соматического обследования пациентов с последующей санацией выявленных очагов инфекции и коррекцией воспалительных проявлений. Сложный многоплановый процесс, предполагающий как системное воспаление с повреждением эндотелия сосудов, так и локальные неврологические повреждения в центральной и периферической нервной системе, диктует необходимость комплексных терапевтических подходов. Последние, наряду с психотропными препаратами, должны включать и сосудистые препараты, метаболическую терапию, иммунокорректирующую терапию, оптимизацию функции желудочно-кишечного тракта (70% всех иммунных клеток сосредоточено в его слизистой оболочке.). Перспективным направлением должно быть признано использование пробиотиков, обладающих свойствами психотропных препаратов («психобиотики»). Развернутые динамические иммунохимические исследования, выполняемые в процессе лечения, должны быть обязательно включены в план ведения пациентов.Сложным аспектом терапии может оказаться ее противоинфекционный компонент. В целом ряде исследований приводились обоснования вовлеченности в патогенез шизофрении различной патогенной флоры (кроме вирусов герпеса – вирусов гриппа, аденовирусов, ретровирусов, бактерий, токсоплазмы и др. [19, 37, 38, 40, 42, 48, 57]. То есть гипотетически речь может идти о латентном полиинфекционном процессе. В связи с этим, ввиду предполагаемой сложности микробиоты при шизофрении, актуальной является интенсификация исследований по разработке препаратов, оптимизирующих функцию рецепторов VDR, связанных с состоянием врожденного иммунитета. ОбсуждениеПроведенное исследование выявило у обследованных больных шизофренией существенные аномалии профилей ауто-АТ – молекул, обеспечивающих гомеостатическую регуляцию самых разных молекулярно-клеточных процессов, в том числе касающихся функционального сопряжения нервной и иммунной систем. У значительного числа пациентов было выявлено повышение уровней ауто-АТ, которое может отражать деструктивные и воспалительные процессы в тканях головного, спинного мозга и периферической нервной системы (GFAP, MBP, NF-200, S-100В, VGCC), а также нарушение проницаемости ГЭБ. В настоящей работе в значительной части случаев было также отмечено повышение содержания ауто-АТ к двуспиральной ДНК и β-2-гликопротеину, которое может указывать на распространенные воспалительные изменения и усиление апоптоза, развитие сосудистых расстройств. Корреляционные связи изученных иммунохимических признаков предполагают сопряженность патологических процессов в астроглие у больных шизофренией с воспалительными проявлениями. Эти данные подтверждают результаты других работ, выявляющих при этом заболевании биохимические маркеры воспалительных реакций и повреждения эндотелия сосудов [31]. Как показывают выявленные в проведенном исследовании изменения в содержании ауто-АТ к MBP, NF-200, VGCC, психиатрическая симптоматика (в частности, связанная с расстройствами мышечного тонуса) может иметь как центральный, так и периферический генез. Полученные данные свидетельствуют о необходимости изучения шизофрении как системного заболевания с использованием не только психиатрического, но и других интегративных медицинских подходов.Результаты проведенного исследования находятся в соответствии с целым рядом данных, полученных при изучении патогенеза шизофрении с привлечением методов других научных дисциплин. В частности, установленные данные, предполагающие дегенеративные процессы в нервной системе, подтверждают результаты некоторых катамнестических МРТ-исследований [45], выявляющих прогрессирующую редукцию структур мозга у больных шизофренией, а также наши данные, установившие с использованием сложных морфометрических индексов прямые МРТ-признаки нейродегенерации при шизофрении, преобладающие над признаками врожденной гидроцефалии [12].Иммунохимические признаки, предполагающие процессы демиелинизации у исследованных больных шизофренией (повышение уровня ауто-АТ к МBP), подтверждают данные посмертных патоморфологических исследований [29], обосновывающих поражение миелиновых оболочек нервов как характерное для шизофрении. Полученные данные в совокупности с результатами отмеченных исследований могут служить структурно-функциональным обоснованием результатов нейропсихологических работ, свидетельствующих о нарушениях корково-корковых и корково-подкорковых взаимодействий при шизофрении [20].Следует отметить, что традиционно подчеркивалась ареактивность глии при шизофрении, что в свое время явилось отправной точкой для квалификации структурных аномалий мозга при шизофрении в качестве аномалий развития. Однако в отдельных патоморфологических исследованиях [35] глиоз все же выявлялся в перивентрикулярном пространстве, височно-лимбических структурах, стволе мозга больных. В большинстве современных исследований подтверждено отсутствие классических признаков астроглиоза при шизофрении [см. обзор 9].В то же время имеются данные об изменениях ультраструктуры астроцитов и экспрессии их маркеров при шизофрении, что свидетельствует об активном вовлечении этих клеток в патологический процесс и их активации [9]. Более того, патоморфологические данные свидетельствуют о том, что дисфункция астроцитов при шизофрении прогрессирует по мере увеличения длительности заболевания [39]. Высказано предположение, что патологические процессы в астроцитах у больных шизофренией связаны с иммунными изменениями, что подтверждается результатами настоящего исследования на основании повышения уровня ауто-АТ к GFAP и S-100 (В).Установленные у обследованных больных шизофренией отклонения в уровне ауто-АТ к белку S-100 (В) согласуется с исследованиями, выявляющими изменения содержания этого белка в сыворотке крови больных [см. обзор 58]. S100 – это группа иммунологически тождественных кислых кальций-связывающих белков, различающихся по молекулярной массе и заряду. Концентрация белков S100 в мозге в 100000 раз превышает содержание в других тканях и составляет до 90% растворимой фракции белков нервных клеток [6]. В мозге S100 синтезируются глиальными клетками, 90% этих белков соcредоточено в астроцитах. В клетке белки S100 локализуются в цитоплазме, и, в меньшей степени, – в синаптической мембране и хроматине. В зависимости от концентрации S-100 оказывают трофическое или токсическое действие на нейроны и глиальные клетки. Они выступают как медиаторы во взаимодействии глии и нейронов и в целом, в качестве одного из узловых молекулярных компонентов сложных внутриклеточных систем, обеспечивающих функциональный гомеостаз клеток мозга[24].Экспериментальные воздействия на белки S1OO обычно не сопровождаются заметным ухудшением соматического состояния животных, но одновременно приводят к резким и разнообразным нарушениям интегративной функции мозга и информационного гомеостаза [24]. Подобные изменения характерны и для больных шизофренией. В этом контексте важно, что отклонения в сывороточном содержании белков S-100 (S-100В) (чаще в сторону повышения), выявленные в целом ряде исследований при шизофрении[58], трактуются как подтверждающие его вовлеченность в патогенез заболевания и участие в нейродегенеративных и/или регенеративных механизмах.Иммунохимические признаки, которые косвенно могут указывать на нарушения водно-электролитного баланса и энергетического метаболизма нейронов (повышение уровня ауто-АТ к VGCC), подтверждаются данными посмертных иммунохимических исследований мозга больных шизофренией [2], определяющих отмеченные нарушения, в частности, связанные с метаболизмом глутамата. Нарушения водно-электролитного баланса могут приводить к отечности мозга, что прежде отмечалось нами при проведении МРТ-исследований [13, 16]. Поскольку повышение иммунорективности ауто-АТ к VGCC является характерным для заболеваний с вовлечением в патологические процессы мозжечка (мозжечковая атаксия) и спинного мозга (боковой амиотрофический склероз) [30, 37], полученные данные позволяют предположить участие упомянутых структур в патологических процессах при шизофрении. Последние могут протекать в более легкой форме, о чем свидетельствует отсутствие у больных шизофренией симптоматики, свойственной отмеченным заболеваниям. Высказанное предположение подкрепляется результатами прижизненных и посмертных морформетрических исследований, обнаруживших структурные аномалии мозжечка при шизофрении [10, 36], а также результатами нейропсихологических исследований, выявляющих дисфункции мозжечка у пациентов и их вклад в нарушение когнитивных функций в целом [5]. Аномалии спинного мозга при шизофрении также отмечались в литературе [19].Следует отметить, что значительная часть представленных в данной работе пациентов была обследована с использованием нейропсихологического метода и метода МР-ангиографии, выявивших у них патологию белых проводящих путей между долями полушарий, между полушариями большого мозга и мозжечком [4, 5], а также нарушение церебрального кровообращения [13]. Последнее характеризовалось функциональной патологией в системе мозговых коллекторов, крупных сосудов и капиллярной сети, взаимосвязанной с анатомической патологией (расширение периваскулярных пространств, периваскулярные кисты, очаги дистрофии в белом веществе мозга). В последние годы также и на посмертном материале [60] были установлены неспецифические изменения ультраструктуры капилляров в префронтальной и зрительной коре при шизофрении, рассматривающиеся как характерные для заболевания.Эти данные подтверждают выдвинутые на основании иммунохимического обследования (повышение иммунореактивности к антигенам MBP и NF-200, β-2-гликопротеину) предположения о патологии аксонов у обследованных пациентов, а также повреждении эндотелия сосудов.Как известно, аномально избыточная продукция ауто-АТ, будучи в большинстве случаев вторичным явлением, отражает первичные аномалии со стороны соответствующих антигенов (например, при развитии локальных воспалительных процессов, аномалиях экспрессии и секреции соответствующих продуктов). При этом повышенная продукция ауто-АТ направлена на активацию клиренса и утилизацию избытка таких продуктов и является саногенной [23]. Существенно реже наблюдается первичное, то есть не обусловленное нуждами организма, патогенное повышение продукции определенных ауто-АТ, которые выступают инструментами иммунометаболических нарушений разной степени выраженности, вплоть до аутодеструктивных реакций [23].Таким образом, аномалии профилей сывороточной иммунореактивности, обусловленной теми или иными аутоантителами, могут (чаще всего) отражать избыточное поступление соответствующих антигенов в межклеточные пространства, например, при патологической активации их продукции и/или избыточной гибели клеток, их продуцирующих. Имеются данные о том, что повышенный уровень ауто-АТ к антигенам тех или иных органов и систем может быть связан с наличием вирусного (внутриклеточного) инфекционного процесса. Так, избыток ауто-АТ к двуспиральной ДНК чаще всего бывает обусловлен активацией процессов апоптоза, вызванной активно реплицирующимися внутриклеточными инфектами (обычно вирусными) [21]. Патологический подъем продукции ауто-АТ к белкам S100 могут вызывать многие варианты вирусов папилломы (по механизмам молекулярной мимикрии). По данным иммунологических исследований [21, 26], аутоиммунным процессам, сопровождающимся выраженной органной деструкцией, предшествуют десятилетиями протекающие инфекционно-воспалительные повреждения, часто вызываемые вирусами герпеса. В связи с этим возможно предположить, что повышенный уровень ауто-АТ к нервной ткани может быть связан с наличием латентной вирусной инфекции (латентный энцефалит), что выдвигалось как гипотеза еще с 20-х годов прошлого столетия и имеет ряд подтверждений на современном этапе развития научных исследований [34]. В части же случаев речь может идти о латентном генерализованном инфекционном процессе. Это предположение подкрепляется накопленными в последние десятилетия данными, свидетельствующими о вовлеченности вирусов (в частности, герпеса) в патогенез шизофрении [52, 59 и др.], что проявляется не только сопряженностью уровня сывороточных противовирусных антител с психопатологической симптоматикой [14, 15, 47], но и с дегенерацией мозговых структур [13, 53]. Дополнительный вклад в эти процессы может вносить и другая патогенная микрофлора [19, 47], в частности, такой внутриклеточный паразит, как токсоплазма [57].Как уже отмечалось, реже аномалии профилей сывороточной иммунореактивности отражают первичную аутоиммунную патологию, в которой ауто-АТ играют роль прямых факторов патогенеза. Являются ли выявленные нами (характерные для больных шизофренией) системные аномалии профилей иммунореактивности указанием на первичные аномалии экспрессии, к примеру, дофаминовых и серотониновых рецепторов и патологическую пролиферацию и апоптоз глиальных клеток? Или же выявленные иммунохимические изменения играют роль прямых факторов патогенеза? Хотя, как рассмотрено выше, больше данных за первое предположение, в рамках проведенного анализа без дополнительных углубленных исследований однозначно ответить на эти вопросы не представляется возможным. Однако уже на данном этапе накопления знаний, свидетельствующих о возможном выявлении у больных шизофренией признаков распространенного воспалительного процесса, коррелирующего с повреждением нервной ткани, встает необходимость проведения тщательного соматического обследования пациентов с последующей санацией выявленных очагов инфекции и коррекцией воспалительных проявлений. Сложный многоплановый процесс, предполагающий как системное воспаление с повреждением эндотелия сосудов, так и локальные неврологические повреждения в центральной и периферической нервной системе, диктует необходимость комплексных терапевтических подходов. Последние, наряду с психотропными препаратами, должны включать и сосудистые препараты, метаболическую терапию, иммунокорректирующую терапию, оптимизацию функции желудочно-кишечного тракта (70% всех иммунных клеток сосредоточено в его слизистой оболочке.). Перспективным направлением должно быть признано использование пробиотиков, обладающих свойствами психотропных препаратов («психобиотики»). Развернутые динамические иммунохимические исследования, выполняемые в процессе лечения, должны быть обязательно включены в план ведения пациентов.Сложным аспектом терапии может оказаться ее противоинфекционный компонент. В целом ряде исследований приводились обоснования вовлеченности в патогенез шизофрении различной патогенной флоры (кроме вирусов герпеса – вирусов гриппа, аденовирусов, ретровирусов, бактерий, токсоплазмы и др. [19, 37, 38, 40, 42, 48, 57]. То есть гипотетически речь может идти о латентном полиинфекционном процессе. В связи с этим, ввиду предполагаемой сложности микробиоты при шизофрении, актуальной является интенсификация исследований по разработке препаратов, оптимизирующих функцию рецепторов VDR, связанных с состоянием врожденного иммунитета.
По другую сторону жизни
|
| |
|
|